随着基因编辑技术的发展,CRISPR/Cas9系统促进了生物医学领域的研究发展。使用CRISPR/Cas9技术,科学家可以在更短的时间内编辑特定基因,包括缺失/插入,特定敲除/敲除和点突变,已经应用于细胞系定制、细胞永生化、微生物基因组改造、植物基因工程等领域。
但是,CRISPR/Cas9的潜力不止如此。除了使用CRISPR/Cas9直接在DNA序列中操作以调节DNA水平的基因表达外,研究人员通过对该系统的修改使其成为基因组对接平台,允许宽范围的基因组工程的应用(图1)。
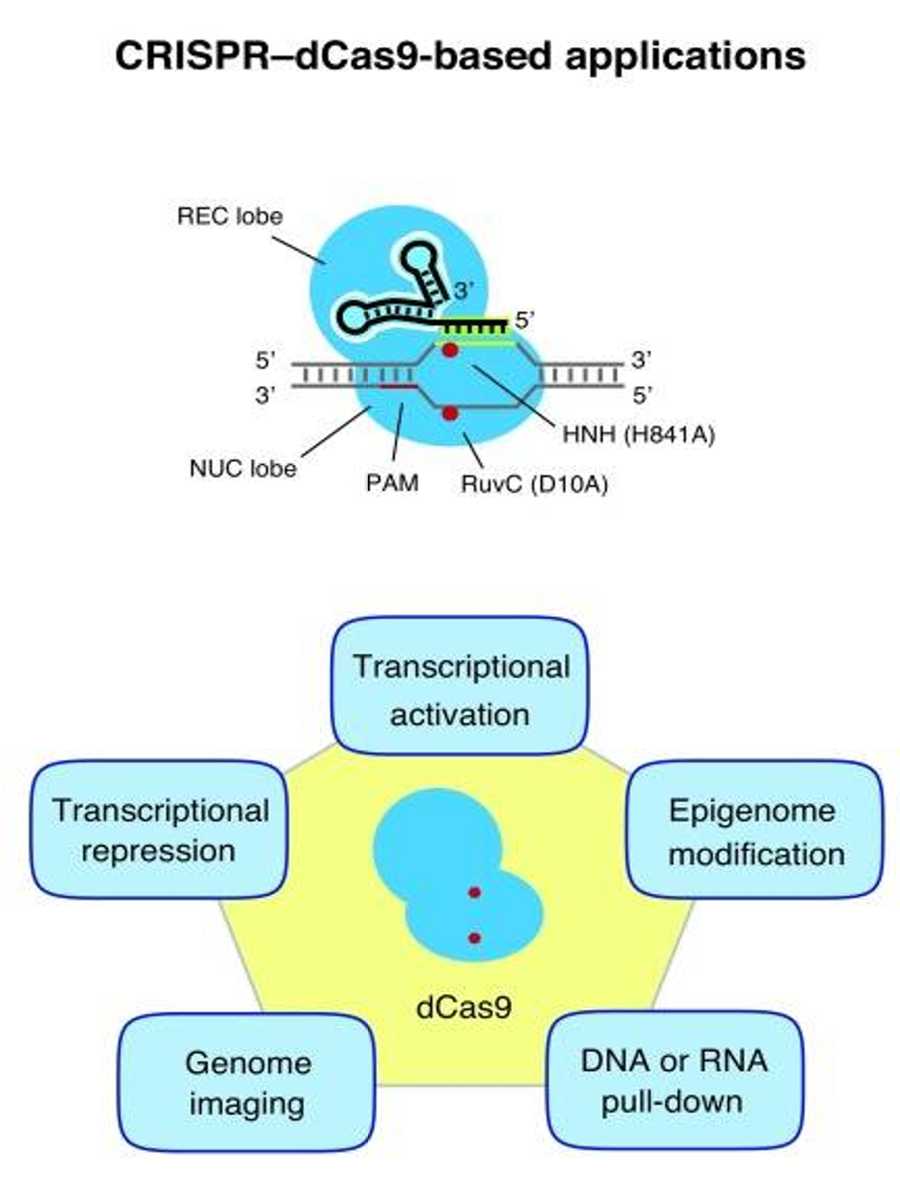
图1. 基于CRISPR–dCas9的基因组工程应用概述(Albert Lo. 2017)。PAM,与原间隔物相邻的序列。
CRISPR/Cas9与表观遗传调控
基因的表观遗传修饰在不同的生物学过程中起重要作用,包括基因调控,iPSC集重编程和维持,基因组印迹,X染色体失活,衰老,神经退行性变,自身免疫调控和肿瘤发生等。
CRISPR/Cas9为研究人员提供了操纵表观基因组并观察其对细胞功能,发育和分化的可能影响的机会(图1)。将DNA甲基化酶,组蛋白乙酰转移酶和脱乙酰酶等酶融合到无活性的dCas9(一种缺乏核酸酶活性但保留DNA结合活性的Cas9),能够使其靶向DNA(脱)甲基化、(脱)乙酰化(图2)。
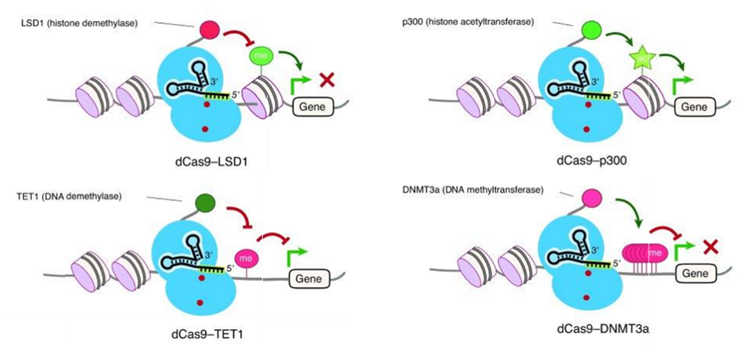
图2. 基于CRISPR–dCas9的表观基因组工程。(Albert Lo. 2017)
目前已经实现了人乙酰转移酶p300与dCas9的融合,并能够在特定靶位点乙酰化组蛋白H3 Lys27,进而有效激活靶基因的转录。
最近另一项研究报道了通过靶向DNA甲基化挽救脆弱X综合征(FXS)神经元的神经缺损,说明了DNA甲基化编辑在基因治疗中的潜力。此外,epiCas9s(Cas9表观遗传效应子)可用于全基因组筛选,以发现表观遗传修饰,染色质状态和表型(例如细胞分化或疾病进展)之间的新关系。这些发现突出了CRISPR/Cas9在表观遗传学研究中的潜力。
CRISPR/Cas9与转录调控
dCas9也可以与靶向启动子区域的转录抑制子或激活子融合,这些dCas9融合蛋白可以导致下游靶基因的强转录抑制(CRISPR干扰或CRISPRi)或激活(CRISPRa)。使用预先设计的gRNA将复合物引导到转录起始位点的上游,从而将Cas9融合到一个特征明确的转录调节域上。Cas9结合到目标DNA序列后,融合的转录调节因子可以募集抑制或激活效应子以修饰基因表达(图3)。
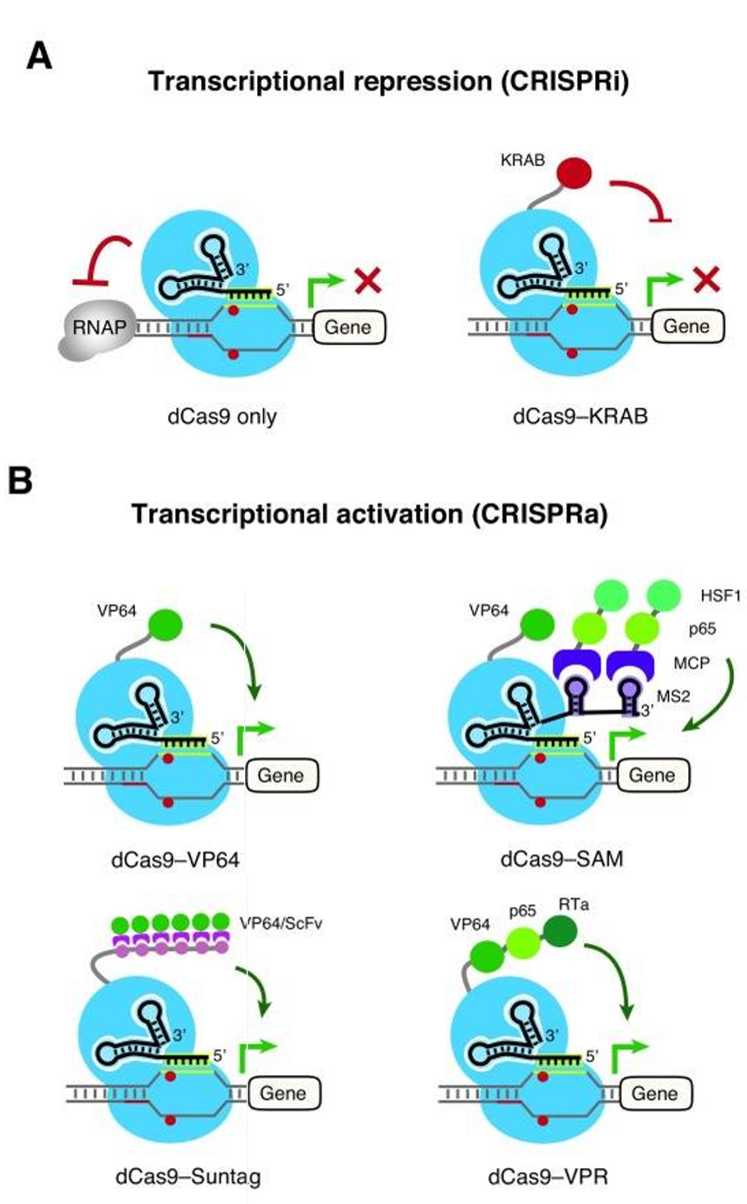
图3. 用于基因表达调控的CRISPR干扰(CRISPRi)和CRISPR激活(Albert Lo. 2017)
直接与单个转录激活子融合是简单的基于dCas9的激活子和阻遏子,例如:
转录激活域VP64,由四个串联复制的单纯疱疹病毒蛋白16(VP16)串联而成,可以连接到dCas9的C端,用于增加基因表达。
同样,可以将dCas9与KRAB阻遏物融合在一起,为基因特异性转录沉默创建一个平台。
CRISPR/Cas9与ChIP
研究人员使用CRISPR,扩展了染色质免疫沉淀(ChIP),以纯化特定gRNA指定的基因组序列。
催化失活的dCas9用于纯化与gRNA结合的基因组DNA。表位标签可以与dCas9或gRNA融合以进行有效纯化,包括3xFLAG标签,PA的各种表位标签和生物素标签,以及抗Cas9抗体。
例如通过将生物素受体位点与dCas9融合来获得生物素标记的dCas9。然后通过针对表位标签的亲和纯化分离基因座。纯化基因座后,可以通过质谱法(蛋白质),RNA测序(RNA)和NGS(其他基因组区域)鉴定与基因座相关的分子(图4)。
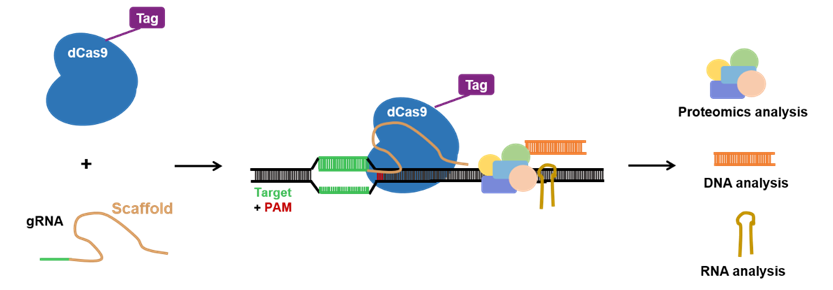
图4. 基于CRISPR系统的enChIP。
与传统的ChIP方法相比,CRISPR介导的ChIP具有优势:
使用经典ChIP进行的大规模测定需要为每种DNA结合蛋白生产和表达多种抗体或带有表位标签的蛋白,但是CRISPR/Cas9系统的模块性质要求仅纯化针对标记的Cas9蛋白的单抗体。
可以直接识别与体内感兴趣的基因组区域相关的分子。
此外,CRISPR/Cas9系统不受低、差异或毒性基因表达的影响。
CRISPR/Cas9与活细胞成像
使用与荧光标记(例如GFP)融合的无催化活性的dCas9,能够将dCas9变成了可定制的DNA标记物(图5)。或者,可以将gRNA与蛋白质相互作用的RNA适体融合,后者会募集荧光蛋白标记的特异性RNA结合蛋白(RBP)以可视化目标基因组位点(图6)。而且多色CRISPR成像可同时追踪活细胞中的多个基因组位点。一种方法使用标记有不同荧光蛋白的正交dCas9(例如化脓性链球菌dCas9和金黄色葡萄球菌dCas9)。另一种方法是使用融合有RNA适体的gRNA,该gRNA与直向同源蛋白相互作用,后者募集被不同荧光蛋白标记的特定正交RBP。
荧光CRISPR系统已被用来动态跟踪重复和非重复的基因组基因座以及活细胞中的染色体作图。可视化特定的基因组基因座需要将许多拷贝的标记蛋白募集到给定区域。
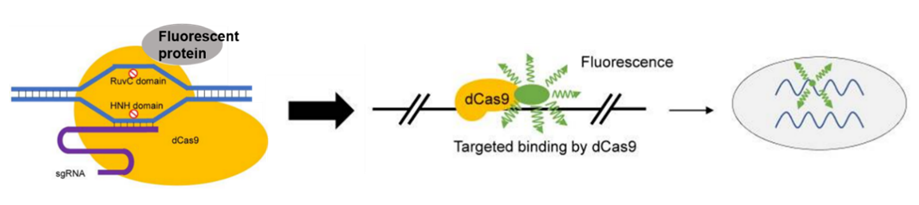
图5. 基于CRISPR/Cas9系统的活细胞成像。(Guang Yang. 2019)
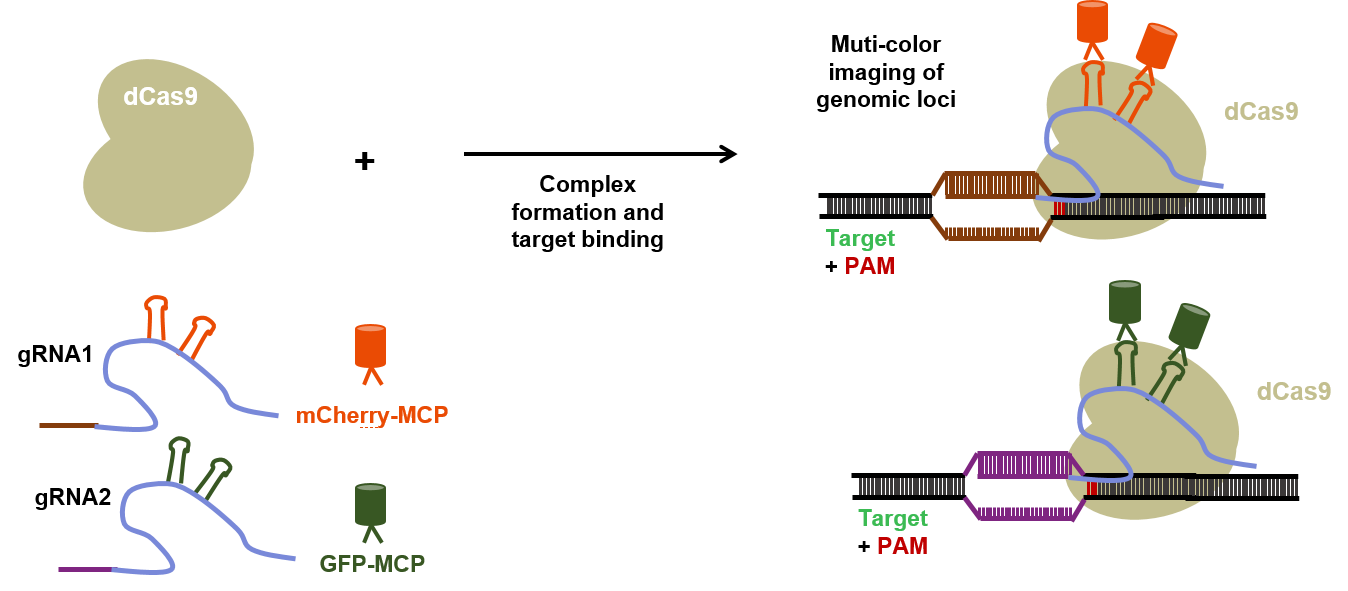
图6. 基于CRISPR/Cas9系统的活细胞成像。
与其他成像技术相比,CRISPR成像具有优势:
gRNA设计的简单性,易于实施;
可针对不同基因组基因座进行编程;
检测多个基因组基因座的能力以及与活细胞成像的兼容性;
CRISPR成像提供了一种方法来检测活细胞中的染色质动力学。
参考文献:
Albert Lo, Lei Qi. Genetic and epigenetic control of gene expression by CRISPR–Cas systems. F1000Research. 2017; 6:F1000 Faculty Rev-747.
BaohuiChen and BoHuang. Imaging Genomic Elements in Living Cells Using CRISPR/Cas9. Methods in Enzymology. 2014; 546:337-354.
Guang Yang and Xingxu Huang. Methods and applications of CRISPR/Cas system for genome editing in stem cells. Cell Regen (Lond). 2019; 8(2):33-41.
Henriette O'Geen. et al. A genome-wide analysis of Cas9 binding specificity using ChIP-seq and targeted sequence capture. Nucleic Acids Res. 2015; 43(6):3389-3404.
Jinzhi Duan. et al. Live imaging and tracking of genome regions in CRISPR/dCas9 knock-in mice. Genome Biology. 2018; 19: 192.
Julianna LeMieux. et al. Fishing for Mutations Using CRISPR-Chip. Genetic Engineering & Biotechnology News. March 25, 2019.
Liu X.S. et al. Muffat J. Rescue of fragile X syndrome neurons by DNA methylation editing of the FMR1 gene. Cell. 2018;172(5):979-992.e976.
Peiwu Qin. et al. Live cell imaging of low- and non-repetitive chromosome loci using CRISPR-Cas9. Nature Communications. 2017; 8: 14725.
Reza Hajian. et al. Detection of unamplified target genes via CRISPR–Cas9 immobilized on a graphene field-effect transistor. Nature Biomedical Engineering. 2019; 3:427-437.