细胞凋亡(apoptosis)是一种在多细胞生物体中发生的程序性细胞死亡形式,属于细胞的正常生理过程,在生物体进化、内环境的稳定以及发育过程中起着重要作用,具有重要生物学意义及复杂的分子生物学机制。
在生物学研究过程中常常需要检测细胞凋亡情况。目前至少有十数种检测细胞凋亡的方法,大致可分为基于细胞形态、生物学功能和生化标记三大类。每一方法都有其优缺点,需要根据实际情况选择适合的细胞凋亡检测方法。
基于细胞形态的方法
电子显微镜检测方法
在透射电镜下,凋亡细胞体积变小。凋亡Ⅰ期(pro-apoptosis nuclei),染色质高度盘绕,出现许多空泡结构;Ⅱa 期细胞核的染色质高度凝聚、边缘化;凋亡晚期出现核解体,产生凋亡小体。

图1. 电镜下细胞凋亡形态变化 (E. Bonanno, 2000)。
缺点:
无法定量(电镜一个视野仅能观察一两个细胞)
实验步骤繁琐(固定、切片到拍照)
并非所有实验室都能配备电镜。
当然,如果文章主角是细胞凋亡,电镜数据还是有必要的,尤其是针对主流期刊。
细胞核形态染色法
相比细胞凋亡的其他形态变化,利用荧光染料配合荧光显微镜对细胞核形态的观察也是较为直接的指标。常用的 DNA 特异性染料有:Hoechst、DAPI以及碘化丙啶(PI)。Hoechst 是与 DNA 特异结合的活性染料;DAPI 为半通透性,用于常规固定细胞的染色;PI不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而将细胞核染红。因此将Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来(Annexin-V/PI法)。

图2. Hoechst染色显示Hela细胞凋亡过程中核染色质变化(Pekka Taimen, 2003)。
基于生物学功能的方法
Annexin-V/PI双染法
磷脂酰丝氨酸(Phosphatidylserine, PS)位于正常细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。Annexin V是一种Ca2+依赖磷脂结合蛋白,对PS具有高度亲和力。将荧光标记(FITC、PE或 biotin)的Annexin V作为探针,利用荧光显微镜或流式细胞仪可检测细胞凋亡的发生。Annexin V联合PI法更加省时,结果更为可靠,是目前检测细胞凋亡的一种方法。
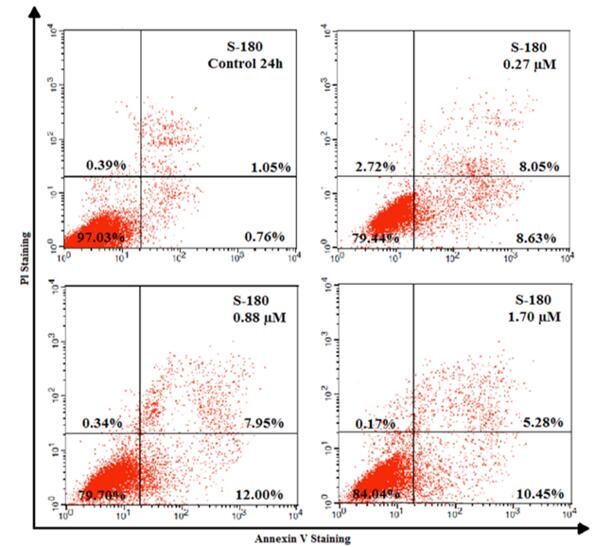
图3. 使用膜Annexin-V/PI通过流式细胞仪分析S-180细胞凋亡(Wanessa Carvalho Pires, 2017)。
缺点:
制备贴壁细胞样品时,容易因消化和吹打造成细胞额外损伤,从而夸大了实验结果,增加了数据变异度。
凋亡细胞的本底荧光或非特异染色的特性会增强,导致荧光飘移,导致定量不准。
线粒体膜电位检测
线粒体跨膜电位的下降也是凋亡细胞一个重要特点,是细胞凋亡过程中初期发生的事件(早于核形态的变化和PS的外翻)。一旦线粒体跨膜电位崩溃,细胞就会进入不可逆的凋亡过程。一些亲脂性阳离子荧光染料如 Rhodamine 123、DiOC6、JC-1、TMRM等,在线粒体跨膜电位存在的情况下可结合到线粒体基质,通过荧光显微镜观察其荧光的增强或减弱可反应线粒体内膜电负性的增高或降低。

图4. 使用JC-1染料通过流式细胞仪检测线粒体膜电位(Wanessa Carvalho Pires, 2017)
基于生化标记的方法
Caspase-3活性检测
Caspase(cysteinyl-aspartic acid proteases)蛋白家族的活化是细胞凋亡的特征,在介导细胞凋亡过程中具有重要的作用。其中Caspase-3作为关键的执行分子在细胞凋亡信号传导的许多途径中发挥功能。Caspase-3正常细胞中以酶原形式存在,在凋亡早期被的活化,但在凋亡晚期及死亡细胞中,Caspase-3活性下降。因此在试验过程中可以通过检测检测Caspase剪切体的含量或Caspase的活性来反应细胞凋亡过程。
DNA损伤检测
在细胞凋亡的后期,Caspase会激活Caspase-Activated DNase(CAD),切割核小体之间的DNA,形成以180-200 bp为单位的DNA片段,经琼脂糖电泳后形成DNA ladder。
缺点:耗时,无法定量,以及结果不稳定
DNA片断原位标记法(TUNEL检测细胞凋亡)
细胞死亡(凋亡或坏死)时,DNA发生断裂。此时大量的粘性 3'-OH 末端,可在脱氧核糖核苷酸末端转移酶(TdT)的作用下,将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸酶或生物素形成的衍生物标记到 DNA 的 3'- 末端,从而可进行凋亡细胞的检测。

图5. 通过TUNEL染色检查睾丸凋亡细胞(Jijing Tian, 2016)。
缺点:
一般只用于组织切片样本的研究
不能区分凋亡与坏死
参考文献:
E. Bonanno. et al. Cell shape and organelle modification in apoptotic U937 cells. Eur. J. Histochem. 2000; 44: 237-246.
Pekka Taimen & Markku Kallajoki. NuMA and nuclear lamins behave differently in Fas-mediated apoptosis. Journal of Cell Science. 2003; 116: 571-583.
Wanessa Carvalho Pires. et al. Ru(II)/diphenylphosphine/pyridine-6-thiolate complexes induce S-180 cell apoptosis through intrinsic mitochondrial pathway involving inhibition of Bcl-2 and p53/Bax activation. Mol Cell Biochem. 2017; 438(1-2):199-217.
Jijing Tian. et al. Histologic study of testis injury after bisphenol A exposure in mice: Direct evidence for impairment of the genital system by endocrine disruptors. Toxicology and Industrial Health. 2016; 33(1): 36-45.